नील बोर के अनुसार परमाणु (Atom) की संचरना Planetary है। परमाणु के केंद्र में एक क्षेत्र होता है जिसे नाभिक (nucleus) कहते है और इसी नाभिक में प्रोटोन तथा न्यूट्रॉन एक साथ रहते है। इस केंद्रीय भाग को सूर्य समझ सकते है तथा नाभिक के चारो तरफ इलेक्ट्रान ग्रह की तरह चक्कर लगते रहते है।
एक सामान्य (Normal) परमाणु में इलेक्ट्रान तथा प्रोटोन ही आवेशित कण (particle) होते है तथा इनकी संख्या आपस में बराबर होती है। इन दोनों कण के अलावा न्यूट्रॉन भी होता है जिस पर किसी भी तरह का कोई आवेश नहीं होता है। इसलिए सामान्य अवस्था में एक परमाणु उदासीन (Neutral) होता है। किसी भी परमाणु में प्रोटोन के संख्या को परमाणु संख्या कहा जाता है। प्रोटॉन तथा न्यूट्रॉन के संख्या के योग (Sum) को परमाणु भार (Atomic Weight ) कहा जाता है।
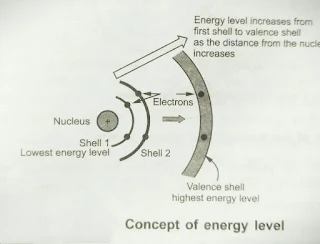
नाभिक के चारो तरफ चक्कर लगाने वाले इलेक्ट्रान नाभिक से एक निश्चित दुरी तथा एक निश्चित कक्षा में होते है। जिसे ऑर्बिट या शेल कहते है। प्रत्येक कक्षा में इलेक्ट्रोनो को संख्या निश्चित होती है। सामान्यतः किसी कक्षा में अधिकतम 2n2 इलेक्ट्रान ही हो सकते है जहाँ n कक्षा की संख्या है। अर्थात पहली कक्षा (n=1) में अधिकतम इलेक्ट्रान की संख्या 2×12= 2 होगी।
नाभिक से एक निश्चित दुरी होने के कारण प्रत्येक कक्षा की ऊर्जा भी निश्चित होती है। जो कक्षा नाभिक से जितना नजदीक होता है वह उतना ही ज्यादा मजबूती से नाभिक से आकर्षित होता है। और इस कक्षा में होने रहने वाले इलेक्ट्रान भी उतने ही ज्यादा नाभिक से बंधे रहते है।
इसके विपरीत जो कक्षा नाभिक से जितना ही दूर होता है ,नाभिक से उसका आकर्षण उतना ही कम होता है तथा इस कक्षा में रहने वाले इलेक्ट्रान भी उतनी ही कम बल के साथ नाभिक से बंधे रहते है ,इन इलेक्ट्रानो पर नाभिक का आकर्षण कम होने के कारण ये इलेक्ट्रान परमाणु के अंदर आसानी से घूमने के लिए आज़ाद होते है इसलिए ये इलेक्ट्रान परमाणु द्वारा विधुत चालन के लिए उत्तरदायी (Responsible) होते है।
इसके विपरीत जो कक्षा नाभिक से जितना ही दूर होता है ,नाभिक से उसका आकर्षण उतना ही कम होता है तथा इस कक्षा में रहने वाले इलेक्ट्रान भी उतनी ही कम बल के साथ नाभिक से बंधे रहते है ,इन इलेक्ट्रानो पर नाभिक का आकर्षण कम होने के कारण ये इलेक्ट्रान परमाणु के अंदर आसानी से घूमने के लिए आज़ाद होते है इसलिए ये इलेक्ट्रान परमाणु द्वारा विधुत चालन के लिए उत्तरदायी (Responsible) होते है।
ऊपर बताये गए नियम 2n2 के अपवाद (Exception) में किसी भी परमाणु के अंतिम कक्षा में अधिकतम 8 इलेक्ट्रान ही हो सकते है। किसी भी परमाणु के अंतिम कक्षा में उपस्थित इलेक्ट्रान को Valence इलेक्ट्रान तथा अंतिम कक्षा को Valence शेल कहते है।
किसी भी इलेक्ट्रान को नाभिक से बांधकर रखने वाली ऊर्जा को बंधन ऊर्जा (Binding Energy) कहते है। जो इलेक्ट्रान नाभिक से जितना दूर रहता है उसकी ऊर्जा उतनी ही ज्यादा होती है और जिसकी ऊर्जा जितनी ज्यादा होती है वह इलेक्ट्रान नाभिक के साथ उतनी ही कम बल के साथ नाभिक से बंधा रहता है।
कपैसिटर क्या होता है तथा यह कैसे कार्य करता है? यहाँ जाने।
अर्थात नाभिक के नजदीक वाले इलेक्ट्रान की ऊर्जा कम तथा Valence शेल में उपस्थित इलेक्ट्रान की ऊर्जा ज्यादा होती है। Valence शेल में उपस्थित इलेक्ट्रान की ऊर्जा अधिक होने के कारण ,इसे परमाणु के कक्षा से बाहर निकालने के लिए बहुत ही कम ऊर्जा की जरुरत होती है।
किसी भी इलेक्ट्रान को नाभिक से बांधकर रखने वाली ऊर्जा को बंधन ऊर्जा (Binding Energy) कहते है। जो इलेक्ट्रान नाभिक से जितना दूर रहता है उसकी ऊर्जा उतनी ही ज्यादा होती है और जिसकी ऊर्जा जितनी ज्यादा होती है वह इलेक्ट्रान नाभिक के साथ उतनी ही कम बल के साथ नाभिक से बंधा रहता है।
कपैसिटर क्या होता है तथा यह कैसे कार्य करता है? यहाँ जाने।
अर्थात नाभिक के नजदीक वाले इलेक्ट्रान की ऊर्जा कम तथा Valence शेल में उपस्थित इलेक्ट्रान की ऊर्जा ज्यादा होती है। Valence शेल में उपस्थित इलेक्ट्रान की ऊर्जा अधिक होने के कारण ,इसे परमाणु के कक्षा से बाहर निकालने के लिए बहुत ही कम ऊर्जा की जरुरत होती है।
जब कोई परमाणु किसी बाह्य ऊर्जा श्रोत (External Energy Source) से ऊर्जा ग्रहण करता है तब परमाणु के कक्षा की ऊर्जा बढ़ जाती है। इससे इन कक्षा में रहने वाले इलेक्ट्रान की ऊर्जा भी बढ़ जाती है।
ट्रांजिस्टर कैसे कार्य करता है ? यहाँ जाने।
जब किसी कक्षा के इलेक्ट्रान की ऊर्जा बढ़ती है तब यह इलेक्ट्रान अपने कक्षा से कूदकर अपने ऊपरी ऊर्जा वाले कक्षा में चला जाता है और यह प्रक्रिया सभी कक्षा के इलेक्ट्रान के साथ होती है। और जब यह घटना बाह्य कक्षा के इलेक्ट्रान के साथ होती है तब यह नाभिक के आकर्षण से आज़ाद होकर बाहर निकल जाता है।
ट्रांजिस्टर कैसे कार्य करता है ? यहाँ जाने।
जब किसी कक्षा के इलेक्ट्रान की ऊर्जा बढ़ती है तब यह इलेक्ट्रान अपने कक्षा से कूदकर अपने ऊपरी ऊर्जा वाले कक्षा में चला जाता है और यह प्रक्रिया सभी कक्षा के इलेक्ट्रान के साथ होती है। और जब यह घटना बाह्य कक्षा के इलेक्ट्रान के साथ होती है तब यह नाभिक के आकर्षण से आज़ाद होकर बाहर निकल जाता है।
यह भी पढ़े